近日,骨科研究所陈亮教授,顾勇副教授,郗焜博士、冯煜博士团队的论文“Magnetically attracting hydrogel reshapes iron metabolism for tissue repair”在Science Advances上在线发表。陈亮教授团队的博士生许眙昌为论文第一作者,陈亮教授、顾勇副教授、郗焜博士、冯煜博士为论文的通讯作者。
作为一种新的细胞程序性死亡形式,铁死亡近年来受到越来越多关注。当铁代谢发生紊乱时,胞内游离铁增多,通过芬顿反应,产生大量活性氧(ROS),细胞膜和细胞器膜表面不饱和脂肪酸被氧化形成过氧化物,直接或间接破坏细胞或细胞器结构,导致细胞死亡。因此,重塑铁代谢,抑制铁死亡对于组织修复意义重大。目前,多项研究表明铁代谢紊乱同样参与椎间盘退变(IVDD)发生发展。芬顿反应产生过量ROS诱导髓核细胞(NPCs)线粒体损伤,加速退变进展。针对胞内铁过载,目前主要通过螯合剂或纳米颗粒清除胞内过量铁离子,发挥抑制铁死亡的作用,但对于胞内铁离子来源缺乏探索,难以取得长久治疗作用。研究显示,胞外铁离子富集是影响胞内铁离子浓度的重要因素,在一系列如转铁蛋白受体1(TFR1)、二价金属离子转运体1(DMT1)等蛋白分子作用下,胞外铁离子进入胞内,增加胞内游离铁浓度,引起铁代谢紊乱触发铁死亡。因此,减少胞外铁离子蓄积,有望重塑铁代谢,取得长久抑制铁死亡效果。而IVDD过程中,胞外铁离子浓度变化,以及如何引起铁代谢紊乱导致NPCs铁死亡仍缺乏相关研究。
IVDD过程中,胞内铁过载触发铁死亡已得到充分证实,而胞外铁离子富集作为胞内铁浓度重要影响因素已受广泛认可。因此,是否存在IVDD过程中,NPCs外铁离子富集,引发胞内铁过载,导致铁死亡的可能。我们前期初步研究发现,退变髓核组织中,铁离子浓度显著升高,而谷胱甘肽过氧化物酶4(GPX4),铁蛋白重链1(FTH1)表达显著降低,并与退变程度显著正相关,表明IVDD过程中,细胞外铁离子升高并诱发NPCs铁死亡。因此,降低胞外铁离子浓度,有望成为重塑铁代谢缓解NPCs铁死亡的突破口。此外,胞外富集的铁离子通过何种通路影响NPCs内游离铁水平仍需进一步挖掘。椎间盘内较大压力使局部注射螯合剂与纳米粒溶液难以维持有效浓度。同时,无法提供力学支撑,NPCs微环境难以恢复。因此,构建一种能够靶向吸附胞外铁离子,重塑铁代谢抑制铁死亡,同时能够提供力学支撑的组织工程学支架,有望解决目前IVDD的治疗困境。
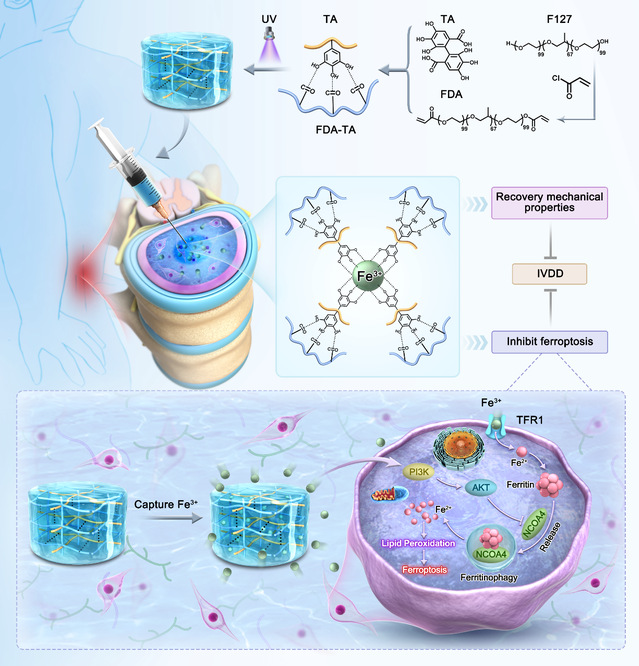
本研究中,为探索退变髓核组织中铁离子浓度、退变程度、铁死亡现象三者之间关联性以及胞外铁蓄积对胞内铁代谢影响,我们首先分别对人、大鼠退变髓核组织进行组织学与分子生物学分析。其次,以上述生物学机制为指引,将丙烯基团(Diacrylate)作为桥梁桥接聚醚F127和丹宁(TA),构建了靶向磁吸铁离子水凝胶(FDA-TA)。F127温敏特性利于水凝胶分布,防止泄露;而丙烯基团的光固化能力赋予FDA-TA优异的力学性能,能够最大程度模拟椎间盘髓核力学强度。由于TA通过氢键的稳定接枝,充分发挥螯合铁离子的能力,显著减少胞外游离铁离子触发NPCs的内源性铁死亡。此外,受益于改良的铁死亡调控性能,FDA-TA可激活PI3K-AKT通路降低NCOA4激发的铁蛋白自噬,维持胞内铁代谢稳态。最后,我们在大鼠模型中验证了靶向水凝胶促进椎间盘修复效果,为IVDD临床治疗一种极具潜力和吸引力的解决方案。
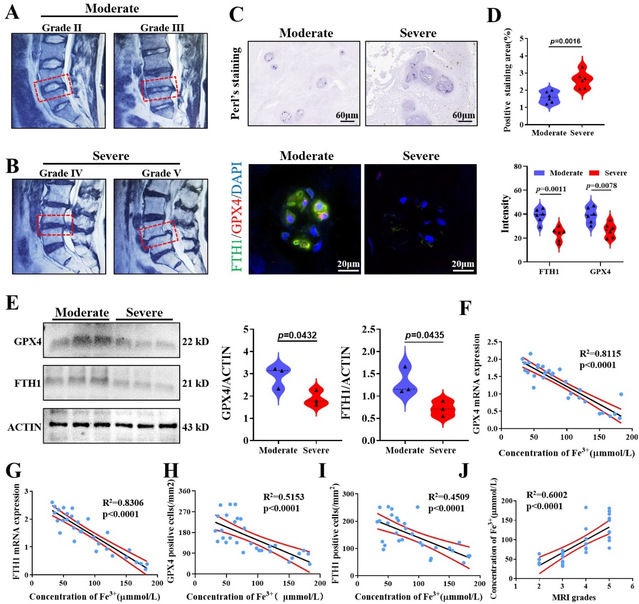
基于术前MRI检查,将Pfirrmann分级为II、III级的病人定义为中度退变,IV、V级定义为重度退变。收取术中摘除的髓核,行普鲁士蓝加强染色,结果表明在重度退变组织中,褐色颗粒明显多于中度退变组织,二者存在统计学差异。作为胞内重要抗氧化蛋白,谷胱甘肽过氧化酶4(GPX4)是铁死亡过程重要的抑制剂,是反映铁死亡程度重要指标。而铁蛋白重链1(FTH1)作为胞内铁离子重要储存蛋白,间接反映胞内铁离子浓度变化。对髓核组织行免疫荧光染色,中度退变组荧光强度显著高于重度退变组。说明就铁死亡程度而言,中度退变组要轻于重度退变组。同时,我们检测不同病人髓核组织中铁离子浓度,相关性分析后我们可以发现,铁离子浓度与GPX4、FTH1 RNA表达水平,免疫组化阳性细胞数成显著负相关,而与退变程度显著正相关。因此,在人髓核组织中,随着退变发展,胞外铁离子浓度明显升高,显著诱导NPCs铁死亡。
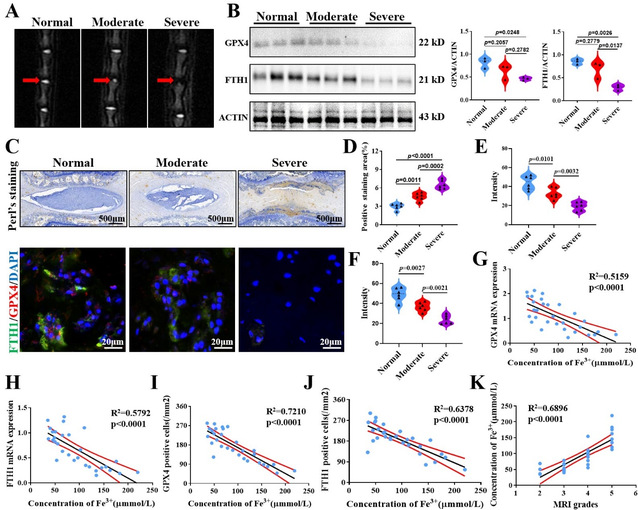
为了进一步在大鼠髓核组织验证这一结论,我们构建大鼠尾椎针刺IVDD模型。GPX4,FTH1表达随着退变程度增加而逐渐降低。这在普鲁士蓝加强染色与免疫组化结果中也得以体现。最后,针对组织中铁离子浓度与各个指标行相关性分析,趋势与人髓核组织情况一致。所以,宏观层面,我们在人与大鼠退变髓核组织详细分析铁离子浓度变化,发现随着退变进展,髓核中铁离子浓度显著升高,同时诱发了NPCs铁死亡。但微观层面,胞外高铁离子浓度诱导的铁死亡对NPCs结构与功能影响是否如已有研究尚需进一步证明。因此,在接下来细胞实验中,我们拟通过氯化铁溶液提升细胞外铁离子浓度,体外评估铁离子对NPCs的影响。
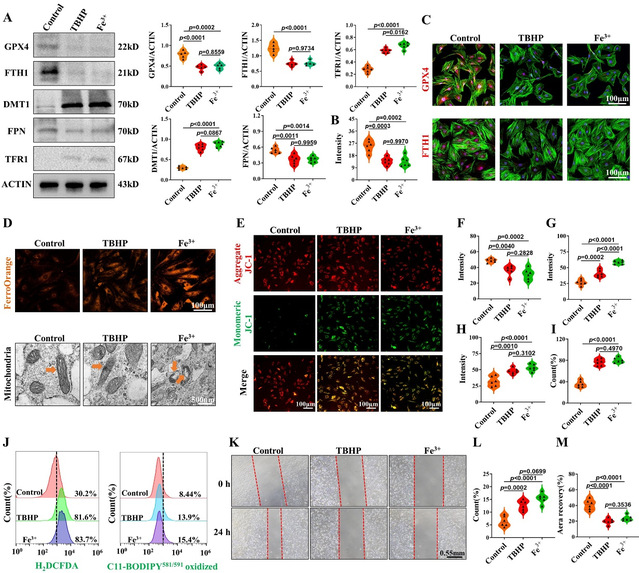
本研究通过组织体内验证了铁离子浓度与铁死亡、IVDD相关性,为了进一步表明铁离子对NPCs的影响,课题组开展体外实验进行观察。用氯化铁溶液对细胞进行干预。而叔丁基过氧化氢(TBHP),铁死亡常用诱导试剂,作为阳性对照。结果表明,高浓度铁离子能够引起胞内铁过载,诱导NPCs铁死亡,产生大量ROS,破坏线粒体结构与功能,影响细胞活性。综合体内髓核组织实验结果,及时清除胞外铁离子,降低铁离子浓度,重塑铁代谢,对于抑制NPCs铁死亡,延缓IVDD具有重要意义。因此,在接下来实验中,作者创造性设计了磁吸效应水凝胶,靶向吸附铁离子,发挥重塑铁代谢的作用。
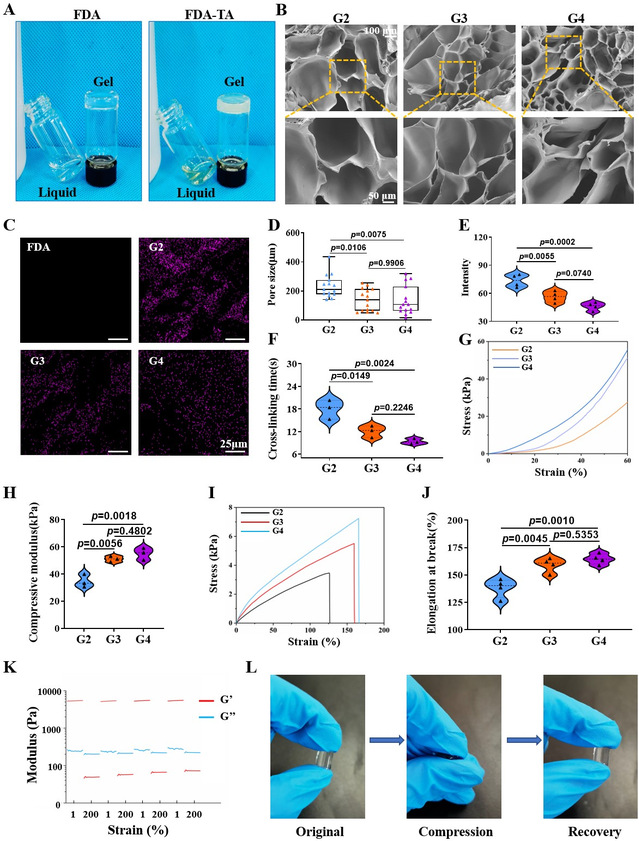
通过大体图可以发现,FDA,FDA-TA均能在紫外光交联后形成较为均质的胶体。由于TA的加入,FDA-TA胶体呈淡黄色。将FDA与TA以体积比2:1,3:1,4:1的比例成胶(分别记作G2,G3,G4)。通过分析孔隙大小、交联时间、力学特性及自愈合效果,最终确定以3:1为最佳配比,进行后续实验。
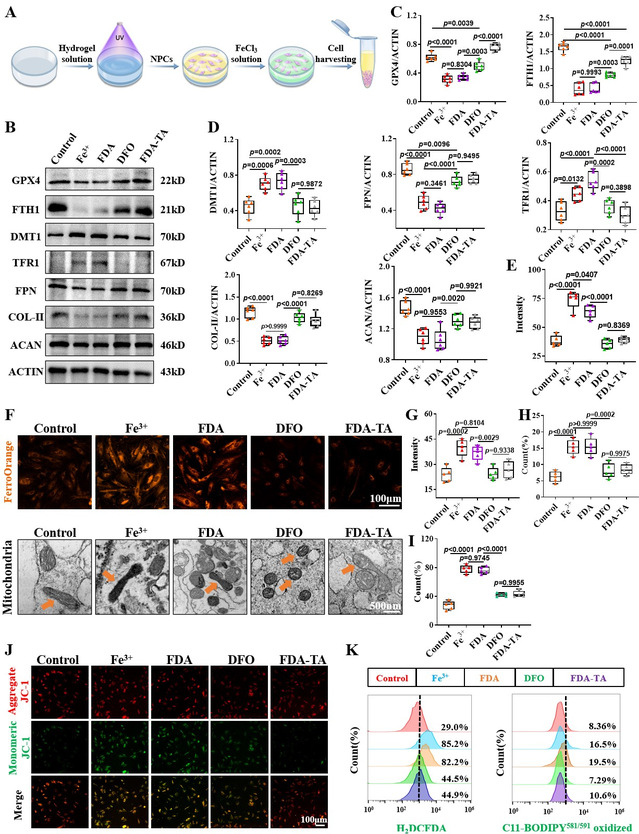
为了体外评价靶向水凝胶治疗作用,我们将水凝胶与NPCs共培养,并与常用铁离子螯合剂DFO进行对比。结果表明,靶向水凝胶能够减少胞内铁离子蓄积,重塑铁代谢,在体外抑制NPCs铁死亡,最大程度维持细胞活性。接下来,为了解释靶向水凝胶抑制铁死亡的潜在机制,作者将行进一步研究深度挖掘。
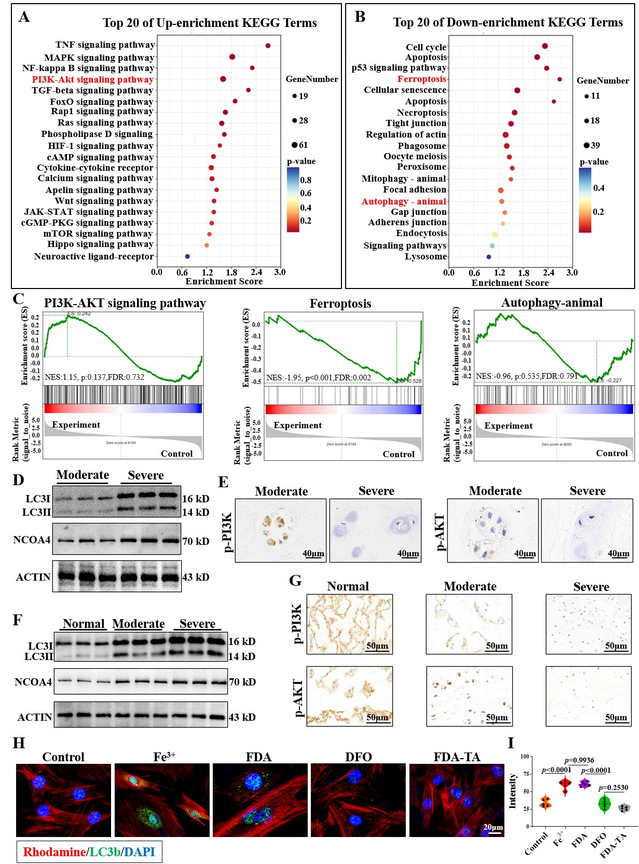
课题组将Fe3+组与FDA-TA组细胞收集行转录组测序分析以挖掘其中的机制。KEEG富集分析结果提示,在TOP 20上调的通路中,PI3K-AKT上调显著。而与此相对的是,在下调的生物学改变中,Ferroptosis, Autophagy-animal显著受抑制。既往研究表明,铁蛋白作为细胞内铁池,与铁离子储存、释放息息相关。当细胞内铁离子浓度下降或需求增加时,在NCOA4介导下,铁蛋白自噬增加,释放游离铁离子。因此,基于测序结果,团队推测在靶向水凝胶治疗IVDD过程中,可能激活了PI3K-AKT,从而抑制胞内铁过载引起的铁蛋白自噬,发挥抑制NPCs铁死亡的作用。为了验证这一猜想,课题组再次在人与大鼠退变组织中验证。结果均表明,随着退变进展,PI3K-AKT表达显著受抑制, NCOA4与LC3b表达显著上调。而FDA-TA则能通过上调PI3K-AKT表达抑制NCOA4介导的铁蛋白自噬。因此,在这部分实验中,通过转录组测序我们推测靶向水凝胶治疗机制,并进行体内外实验验证这一猜想,接下来将通过体内实验评估靶向水凝胶治疗效果。
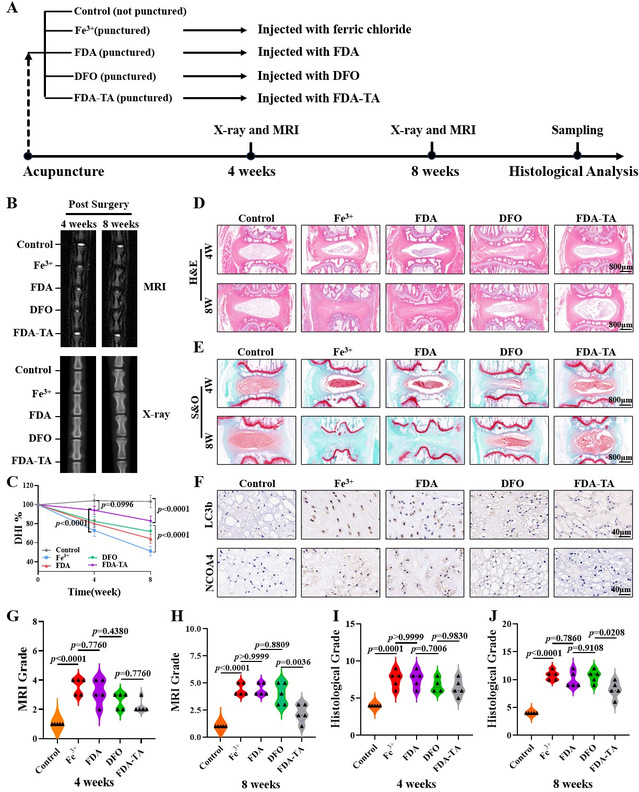
作者构建大鼠尾椎针刺椎间盘退变模型,依次穿刺Co6/7,Co7/8,Co8/9,Co9/10,分别注入氯化铁溶液,FDA溶液,DFO溶液,FDA-TA,Co5/6作为阳性对照组。在术后4周、8周行影像学观察,主要观察指标为椎间盘MRI T2加权像信号强度,椎间隙高度。结果表明各实验组椎间隙高度均有下降,但FDA-TA组下降较慢,至第八周时才与Control组表现出明显差异,显著优于其他实验组。MRI扫描结果提示,各实验组椎间盘信号强度随着退变时间延长,均有一定程度下降。但FDA-TA组信号强度最接近对照组。组织学染色结果表明FDA-TA组,髓核组织体积有所增加,界限清晰,组织学评分最接近Control组。
课题组已在上一节中详细探索靶向水凝胶作用机制,为了综合评估体内治疗效果,体内验证必不可少。第八周时对不同组髓核组织行普鲁士蓝加强染色,考察铁离子浓度。结果显示,FDA-TA组阳性染色区域显著较低,与Control组接近。而LC3b与NCOA4免疫组化结果提示,Fe3+组与FDA组阳性细胞显著多于DFO与FDA-TA组,说明NCOA4参与的自噬过程在DFO与FDA-TA组受到抑制。同时,免疫荧光染色结果表明,DFO与FDA-TA组GPX4,FTH1荧光强度显著较强。最后,为了分析治疗后铁死亡相关蛋白表达情况,我们行WB分析,结果表明GPX4,FTH1,p-PI3K, p-AKT表达在Fe3+组与FDA组较弱。与之相反的是,LC3B,NCOA4表达在Fe3+组与FDA组明显较弱。因此,研究通过体内实验中充分验证了靶向水凝胶削弱铁蛋白自噬,重塑铁代谢,抑制铁死亡,治疗IVDD效果,有望为铁代谢紊乱背景下IVDD提供新的治疗策略。
文章题目:Magnetically attracting hydrogel reshapes iron metabolism for tissue repair.
文章网址:https://www.science.org/doi/10.1126/sciadv.ado7249